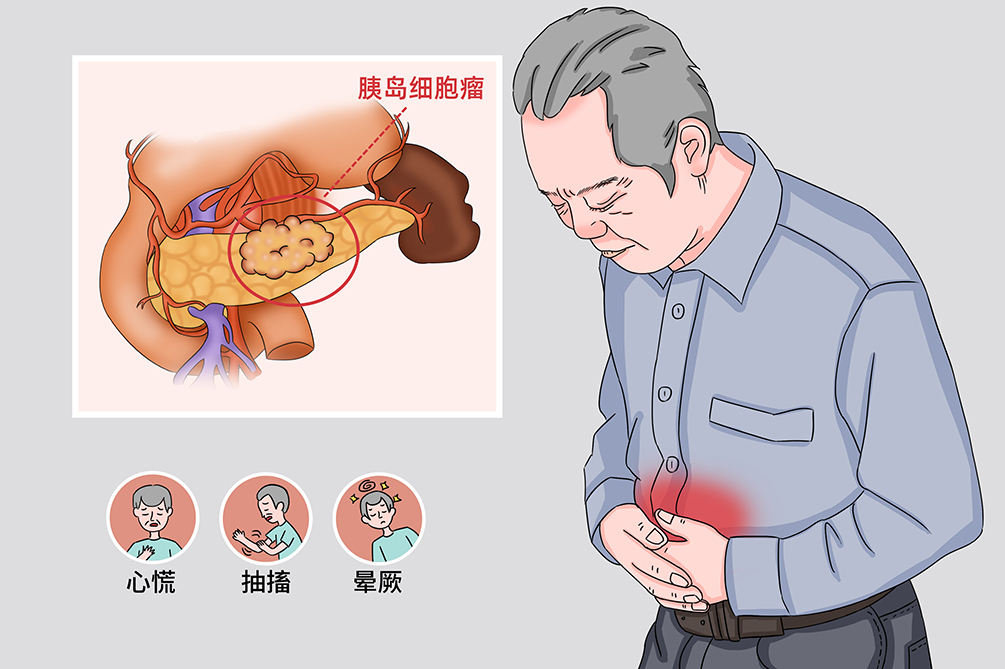
胰岛细胞瘤是发生于胰腺内分泌组织的一类罕见肿瘤,该名称已很少使用,“胰腺神经内分泌肿瘤”被大多医师多采用。因某些肿瘤类型可分泌多肽类激素,包括胰岛素、胰高血糖素、促胃液素、生长抑素,也曾被命名“胰腺内分泌肿瘤”。因胰岛内分泌细胞均为胺前体摄取脱羧(APUD)细胞,故此前也被称作”APUD细胞瘤“。
- 就诊科室:
- 内分泌科、肿瘤科
- 是否医保:
- 是
- 英文名称:
- islet cell tumor
- 疾病别称:
- 胰腺神经内分泌肿瘤、APUD细胞瘤、胰腺内分泌肿瘤
- 是否常见:
- 否
- 是否遗传:
- 部分可遗传
- 并发疾病:
- 无
- 治疗周期:
- 终身治疗
- 临床症状:
- 心慌、抽搐、晕厥、腹泻、腹痛、黄疸、腹部肿块
- 好发人群:
- 胰腺炎患者、肿瘤家族史者、糖尿病患者
- 常用药物:
- 奥曲肽、兰瑞肽、帕瑞泰
- 常用检查:
- CT、MRI、超声胃镜(EUS)、细针穿刺细胞学检查
功能性胰岛细胞瘤
包括有分泌功能的α细胞瘤、β细胞瘤、D细胞瘤、D1细胞瘤等,可出现各种内分泌紊乱症状,以胰岛素瘤(β细胞瘤)多见,又称内源性高胰岛素血症,多见于青壮年,女性多于男性,多发生于胰腺体尾部(该处胰岛组织较胰头多),多数单发,甚至为微小肿瘤,仅数毫米,瘤体呈类圆形,表面光滑、边界清楚、包膜不完整,可向周围胰组织浸润。
非功能性胰岛细胞瘤
较少见,发病年龄多在20岁以下,女性较多见,常为单发,多数为良性,多位于胰腺体尾部,体积一般较大,可达5~10cm,瘤体多呈类圆形或分叶状,包膜完整,瘤内常有不同程度出血和囊变。组织学上与功能性胰岛细胞瘤相似,但间质血管丰富、纤维组织增生明显,可伴玻璃样变。
胰岛细胞瘤是一组异质性很大的肿瘤,病因尚不明确,临床表现以及临床进程差异明显,约有90%的胰腺神经内分泌肿瘤为散发性,小部分约10%与家族性遗传综合征有关。
遗传综合征
多发性内分泌腺瘤综合征Ⅰ型(MEN1)
遗传型最常见于MEN1综合征,约30%~80%的患者可出现胰岛细胞瘤,多为较小的多发无功能性肿瘤,大多数分化较好,与MEN1抑癌基因突变有关。
VHL病(Von Hippel-Lindau disease,VHL)
本病中胰岛细胞瘤发病率约为15%,一般为较小的多发的无功能性肿瘤,很少发生肝转移,预后较散发者好,VHL基因突变在散发型中极其罕见。
神经纤维瘤病Ⅰ型(NF1)
本病患者中胰腺神经内分泌瘤的发病率不足10%,NF1基因突变引起相关通路活动增加,可能促进肿瘤向恶性进展。
结节性硬化症(TSC)
TSC中胰岛细胞瘤更为罕见,仅在1%的患者中出现,主要为无功能性肿瘤。
散发型肿瘤
发生过程中不仅包括典型的基因突变,染色体改变、基因融合等也在肿瘤发生过程中发挥重要作用。另外,肿瘤的发生还牵涉到表观遗传学的改变。在胰岛细胞瘤中,基因突变等遗传改变导致的肿瘤不足一半,说明表观遗传学改变在肿瘤发生过程中有着不可忽视的作用。
胰岛素瘤常因饥饿、饮酒、感染、活动过度等应激而发病,多数由偶发至频发,逐渐加重,甚至每天发作数次,发病时间可短至数分钟,长至持续数天,其余肿瘤尚无明确的诱发因素。
胰岛细胞瘤年发病率为1/100000,约占原发性胰腺肿瘤的3%,可以散发发病,也可以是家族多发内分泌肿瘤(MEN)的组成部分。胰岛素瘤是最常见的功能性胰岛细胞瘤,约占年住院患者的1/25万,男女发病比例为2:1,可发生于任何年龄组,20岁以下少见,约2/3的患者年龄为31~50岁,平均发病年龄为50岁,95%为单发腺瘤,97%为良性。
胰腺炎患者
可能是长期慢性炎症反应导致的细胞恶变,具体机制尚不明确。
肿瘤家族史者
MEN1型患者的家属,胰岛细胞瘤的发病率较正常人显著升高。
糖尿病患者
长期高血糖状态,且多合并血脂代谢紊乱,加重胰腺的负担,刺激胰腺细胞恶性增殖。
功能性的胰岛细胞瘤因所分泌的激素不同,临床症状差异较大,无功能的肿瘤多在肿瘤增大出现局部压迫症状时被发现。
激素分泌症状
胰岛素瘤
临床症状多种,与低血糖发展的程度有关,第一组是低血糖造成的脑部症状,表现为头痛、复视、焦虑、饥饿、行为异常、神志不清、昏睡,以至昏迷,或一过性惊厥、癫痫发作,导致永久性中枢神经系统障碍。另一组症状继发于低血糖后,儿茶酚胺代偿性释放入血,表现为出汗、心慌、震颤、面色苍白、脉搏细速。
Whipple三联症包括:
空腹时低血糖症状发作。
空腹或发作时血糖低于2.8mmol/L(50mg/dl)。
进食或静推葡萄糖可迅速缓解症状。
胃泌素瘤
胃泌素瘤为少见病,80%的胃泌素瘤为散发型,20%为MEN-Ⅰ相关型。胃泌素瘤导致高促胃泌素血症及胃肠道过量胃酸分泌,典型的症状是顽固性消化道溃疡和腹泻。
胰血管活性肠肽(VIP)瘤
是一种较罕见的胰腺内分泌肿瘤,来源于胰岛D1细胞的良性或恶性肿瘤。分泌性腹泻是本病最明显的症状,水样泻量大且持续时间长,其他包括低钾血症、高钙血症、低胃酸或无胃酸、手足抽搐、皮肤潮红等。
生长抑素瘤
来源于胰岛D细胞的肿瘤,肿瘤释放大量的生长抑素,引起脂肪泻、胃酸减少、胆石症(多表现为胆绞痛)、糖尿病(多表现为多饮、多食、多尿、体重减轻)等综合征。
生长激素释放因子瘤
是一种极为罕见的内分泌肿瘤,可位于胰腺体、尾部,也可见于肺部、小肠,一般多发,肿瘤体积较大,可导致颌面部变长变宽、闭唇肥大、头痛、多汗、乏力、肢端感觉异常等。
胰高血糖素瘤
典型表现为皮肤改变、表层坏死性红斑、角化细胞开始液化,常常出现在腹股沟区及其他皮肤表层破损部分,后转移至四肢,蔓延至全身,导致糖尿病、体重减轻、低氨基酸血症、贫血、口腔炎、静脉血栓形成等一系列综合征。
胰腺ACTH瘤
是指某些胰岛细胞瘤能分泌ACTH,属于罕见类型的胰腺神经内分泌肿瘤,临床表现为轻度库欣综合征,包括肥胖、高血糖、高血压、骨质疏松、皮肤紫纹、全身肌肉萎缩,以及雄激素过多造成的多毛、男性化、性功能异常、失眠和情绪不稳定等精神症状。部分患者可合并卓艾综合征(顽固性消化性溃疡和腹泻)、胰岛素瘤(头痛、复视、心慌、面色苍白、出汗)、类癌综合征(阵发性面色潮红、低血压、眼眶周围水肿、流泪)的症状。
无功能性肿瘤的症状
无功能性胰腺神经内分泌肿瘤不产生相关的内分泌综合征,临床表现不特异,通常在体检或因其他疾病就诊检查时被发现。若没有及时发现,那只有当肿瘤增大、压迫附近结构或出现转移相关并发症时,患者才表现相应症状,常见的临床症状为腹痛、消瘦、梗阻性黄疸、厌食、恶心、腹部肿块、腰痛等。
早发现、早治疗对改善疾病的预后有重要作用,因此,对于疾病的好发人群应定期筛查,高度可疑的病人应尽早就医,有反复低血糖发作等症状时及时就医。由于本病包括一大类综合征,症状较多且不典型,因此给诊断造成较大的困难,影像学检查可为该病定位诊断提供客观的依据。
对于有肿瘤家族史的高危人群,应重视体检筛查,必要时在医师指导下进一步检查。
对于有典型激素分泌症状或肿瘤压迫症状的病人,高度可疑胰岛细胞瘤时,应尽快至医院检查。
大多数建议胰腺外科、肿瘤科或内分泌科就诊。
部分地区医院无胰腺外科,可选择普外科就诊。
目前有什么症状?
症状发生时间有多久了?
是间断发作,还是持续性?
发病前有何诱发因素?
家族中是否有肿瘤病史?
查体
肿瘤增大时可触及腹部包块,部分病人腹部压痛明显,淋巴结转移时可触及固定、无痛的淋巴结。
实验室检查
嗜铬粒蛋白A(CgA)
大多数病人血清CgA升高,它是一种常用于诊断和判断预后的肿瘤标志物,其敏感性和特异性取决于肿瘤的类型和大小,可以评估治疗效果,是疾病进展和生存、治疗反应的预测因子,可以预测和反映疾病复发。
神经元特异性烯醇化酶(NSE)
神经元损伤后释放的酶类,存储在细胞质内,可用于鉴别非神经内分泌肿瘤。
影像学检查
CT
具有良好的特异性和灵敏度,对于疑似病人通常首选CT。该类肿瘤是典型的富血供肿瘤,动脉期和静脉期均明显增强,仔细评估CT检查结果有助于疾病的鉴别诊断。
MRI
优点是减少了辐射的暴露,在检测较小的胰腺病变和肝转移方面比CT具有更高的灵敏度,被广泛用于疾病进展的分期和评估。
PET-CT
放射性镓标记的PET-CT最近成为诊断疾病的金标准,它还可以明确肿瘤的侵袭性和提供相关预后信息,阳性患者预后较差。
EUS(超声胃镜)
EUS是将超声和内镜结合在一起的检查方法,经过胃壁或十二指肠对相邻的胰腺进行全程检查,是目前胰腺肿瘤早期诊断及术前分期的重要方法。其优点是高灵敏度,可以提供高分辨率的胰腺影像,可以检测直径<2~3mm的病变,对于出现激素综合征提示肿瘤可能,但常规的影像学检查缺乏诊断证据的病人,是非常有价值的诊断方法。
生长抑素受体显像(SRS)
常用于肿瘤的成像,以及确定哪些病人适合做肽受体放射性核素(PRRT)治疗,具有较高的灵敏度和特异度,可以作为评估疾病临床分期的检查方法,在疾病根治后的随访中也较常应用。
细胞学检查
EUS-FNA检查
即内镜超声引导下细针穿刺活检,可以实现组织学诊断,并量化肿瘤的分级。
胰岛细胞瘤的诊断包括定性诊断和定位诊断。
定性诊断
患者的临床综合征表现是功能性肿瘤定性诊断的关键,实验室可检测血清中特异的激素水平。此外,血清中特异性的蛋白,如CgA、NSE可以作为胰岛细胞瘤重要的辅助诊断标志物。
定位诊断
明确原发肿瘤的部位,同时评估肿瘤周围淋巴结的状态及是否有远处转移,影像学检查对肿瘤有良好的诊断价值。
本病包括一系列复杂的综合征,临床表现复杂多样,且发病率较低,是临床的少见病,医师和患者均应该提高警惕和对疾病的认知水平,避免误诊、漏诊。另外,诊断时注意与以下疾病进行鉴别:
胰腺导管腺癌
功能性胰腺神经内分泌肿瘤较好与之鉴别,但无功能性肿瘤应与胰腺常见肿瘤,如导管腺癌进行鉴别。两者在预后、恶性程度、治疗方法上有较大的区别,影像学及穿刺活检可辅助诊断。
胰岛细胞增生症
本病是高胰岛素血症性低血糖的常见原因,其低血糖多表现为餐后低血糖,根据临床表现和生化检查较难与胰岛素瘤进行鉴别,但选择性动脉钙刺激静脉采血检查显示胰岛素的分泌来自整个胰腺时,多提示胰岛细胞增生症,最终确诊需要依赖病理诊断。
疾病准确的分级和分期对于确定治疗方案至关重要,手术切除肿瘤是唯一的根治方法。已经发生远处转移或进入晚期的病人,治疗目的主要是控制肿瘤生长、减少肿瘤负荷、延长存活期、减轻局部症状和控制激素过量引起的全身症状。
生长抑素类似物可用于治疗功能性肿瘤分泌各种激素引起的症状,如腹泻、面部潮红等。对于不可切除的功能性肿瘤各类激素相关综合征治疗效果较好。非功能性肿瘤表达生长抑素受体,故生长抑素类似物也可以作为控制不可切除的非功能性肿瘤生长的一线药物,常用的有以下几种。
奥曲肽
奥曲肽长效抑制剂目前被推荐用于高分级的功能性和非功能性的胰腺神经内分泌肿瘤,用于控制激素分泌过多的症状,长效制剂具有很好的耐受性和安全性。
兰瑞肽
用于不可切除、中度分化、局部晚期或转移性的胰岛细胞瘤,可提高病人的无进展生存期,具有强大的抗肿瘤作用,具有良好的安全性和耐受性,可作为早期抗肿瘤的一线治疗药物。
帕瑞肽
一种长效生长抑素类似物,具有提高生长抑素受体激动剂活性的作用,可显著抑制肿瘤细胞生长,但使用时需要预防高血糖的发生。
可切除肿瘤的外科治疗
对于可切除的胰岛细胞瘤病人,在技术可行的情况下应手术切除,严重的合并症或高手术风险、广泛转移性疾病,或非常小和散发的非功能性肿瘤除外。常用的手术方式包括:
剜除术
通常用于特定的病例,包括胰头部小的功能性肿瘤。
远端胰腺切除术
包括胰体和尾部,行或不行脾脏切除术。
胰十二指肠切除术
常见于胰腺头部不能行剜除术的肿瘤,切除肿瘤应包括区域淋巴结清除术。
晚期疾病的外科治疗
主要以控制疾病症状、延长生存期为目的,减瘤手术不是根治性的。局部晚期疾病和(或)远处转移,完全切除可行的情况下,要切除原发肿瘤和转移灶。肝转移的病人需部分肝切除术,使用生长激素类似物后胆道疾病风险增加,考虑对预期长期使用奥曲肽治疗病人行胆囊切除术。
肽受体放射性核素治疗(PPRT)是一种肿瘤靶向放疗,通过将放射性核素与生长抑素类似物偶联来诱导肿瘤细胞死亡,对生长抑素受体阳性和进展期的病人,可作为二线、三线治疗方法。PPRT作为单一疗法,和其他疗法相结合可用于治疗不可切除和转移性肿瘤,能够显著改善病人生活质量。
常用的全身治疗方法之一,可破坏细胞的有丝分裂,对快速增殖的恶性肿瘤更有效,是高分级肿瘤的首选一线治疗方案。常用的化疗方案为卡培他滨(CAP)联合替莫唑胺(TEM),CAP-TEM在转移性肿瘤的治疗有效。
靶向治疗
无论Ki-67或肿瘤负荷如何,在生长抑素类似物或全身化疗治疗无效后,可以使用靶向药物治疗G1、G2级胰岛细胞瘤,用于控制疾病的进展,缩小肿瘤或缩小手术切除范围。常用药物有:
舒尼替尼
是一种口服多靶点酪氨酸激酶抑制剂(TKI),用于治疗进展期、分化良好的、不可切除的、局部进展或转移性疾病。
依维莫司
是一种口服哺乳动物雷帕霉素受体抑制剂,可显著延长进展性晚期病人的无进展生存期,且严重不良事件发生率较低,可作为有症状、不可切除的以胰岛素分泌为主的病人的一线治疗。
尽管本病转移发生率很高,但与胰腺癌相比,预后良好,主要取决于病理分级、肿瘤的大小、增殖指数和分化程度。
该疾病部分早期患者尚可治愈。
随着诊疗技术的提升,该疾病的生存率有了显著的提高,尤其是晚期疾病病人,但对患者的寿命仍有所影响,具体存活周期视患者病情而定。
本病需定期随访,以便及时发现复发或转移,避免严重不良的并发症,争取治疗机会。根治性手术后的病人3个月复查一次,稳定后1年复查一次,需复查10年。未进行手术的低危患者3个月至半年复查一次,稳定后1年复查一次,若有不适的情况随时医院就诊。
胰岛细胞瘤包括一系列症状复杂的综合征,不同的疾病类型临床表现差别较大,其饮食方案也有所差异。
胰岛素瘤分泌过多的胰岛素,长时间空腹易发生低血糖,应规律三餐,必要时晚间或清晨酌情加餐。高纤维素的食物有利于低血糖的良好恢复和缓解,饮食中应适当增加纤维素的比例。为避免低血糖症状出现,应随身携带糖果。
血糖高的病人应限制淀粉、高糖类食物的摄入量。
胰血管活性肠肽瘤腹泻、呕吐严重时,应当禁食,症状稍缓解后根据情况选择流质、半流质饮食。
生长抑素瘤胆石症和脂肪泻的病人,应饮食清淡、易消化的食物,避免油腻、辛辣、刺激性食物。
禁忌暴饮暴食。
手术后的病人应禁食5天,从第6天开始流质饮食,逐渐过渡到半流质、正常饮食。
胰岛细胞瘤的病人常有病情进展导致的情绪不稳定、抗肿瘤治疗出现不良反应等多种情况,需加强对病人的护理,以期最大限度地减少不良反应的发生,提高治愈率。
了解常用药物的作用、不良反应、使用方法、注意事项。
适当体育活动,如慢走、太极拳、瑜伽等,提高机体的抵抗力,但不宜过度运动。
手术后的病人应加强病情监测,避免术后并发症,如出血、胰瘘、粘连性肠梗阻、胃轻瘫等情况,需密切观察患者引流管有无血凝块、生命体征和意识情况,有无发热、腹痛、腹泻、腹胀等症状,及时对症处理。
化疗及化疗后的病人,注意观察肢体是否红肿、疼痛,避免静脉炎的情况。若出现恶心、呕吐等症状,可使用保护胃黏膜和止吐药。若出现易感染的情况,应及时告知医师,注意检查是否有骨髓抑制。
用药期间应遵医嘱定期复查肝功能、胆囊彩超、心电图、血糖、血脂情况。
出院后的病人应注意监测血糖、血压情况,观察有无腹泻、恶心、面色苍白、肢体麻木、腹部包块等症状,定期医院随访。
关注病人的心理状况,及时心理疏导,避免焦虑、抑郁等不良情绪。
胰岛素瘤的患者低血糖发作时,应保护其安全,避免晕厥后坠床,保护口腔,防止咬伤,有条件时尽快抽静脉血或指尖血,监测血糖值,给患者口服糖水,直至低血糖症状消失。
提高对疾病的警惕和认识,早发现、早治疗。对于存在明确诱发因素的疾病类型,应避免接触诱因。对于已经确诊的情况,应全面、系统、规范诊疗,预防复发和转移。
对于未使用降糖药物的情况下,反复发作的低血糖,应考虑胰岛素瘤的可能,建议尽早医院就诊。
避免饥饿、饮酒、感染、活动过度、情绪激动等应激情况。
积极治疗胰腺原发疾病,如慢性胰腺炎。
养成良好的生活习惯,注意戒烟、限酒。
预防糖尿病的发生,长期高血糖可诱发胰岛细胞发生病变,在糖尿病前期就应注意生活方式的调整,定期检测血糖等。
对于患有免疫缺陷疾病的患者应注意避免辐射环境,做好产前咨询以及孕期检查。
4954点赞
参考文献
[1]中华医学会外科学分会胰腺外科学组编著.胰腺神经内分泌肿瘤治疗指南(2014)[J].中华肝胆外科杂志,2014(12):841-844.
[2]中国临床肿瘤学会神经内分泌肿瘤专家委员会编著.中国胃肠胰神经内分泌肿瘤专家共识[J].临床肿瘤学杂志,2016(10):927-946.
[3]廖二元著.内分泌代谢病学[M].人民卫生出版社,2012:1046-1079.
[4]任成山.现代临床疾病防治学[M].郑州大学出版社,2012:780-783.
[5]张哲著.胰腺神经内分泌肿瘤外科治疗的围术期观察与护理体会[J].国际护理学杂志,2019(24):4153-4155.
[6]张小红主编.腹部常见疾病超声诊断分册[M].2014:77-78.
